2022年8月9日,再鼎医药在公布的第二季度财报中表示,基于对竞争格局的评估,再鼎决定降低其CD47抑制剂ZL-1201研发的优先级,放弃了该药物的II期试验计划。现在将“寻求对外授权的机会”。
2022年8月16日,天境生物公开披露,艾伯维终止了Lemzoparlimab(来佐利单抗,TJC4)+阿扎胞苷+venetoclax 联合治疗骨髓增生异常综合征(MDS)/急性髓系白血病(AML)的I期临床,具体原因未披露,但明确并非涉及任何安全性问题。
显然,这两家药企似乎都意识到了开发CD47产品的困难,在权衡利弊后选择了退出。那么,风口过后的CD47赛道,未来将何去何从呢?
早在1990年,Hattie Gresham团队在细胞膜上偶然发现了一个整合素相关蛋白(IAP)即CD47。1996年,Frazier教授发现CD47的第一个配体凝血酶敏感蛋白-1(thrombospondin-1,TSP1),这个配体跟细胞的增殖,生长和分化有关。
1999年,斯坦福大学的Irving Weissman发现了CD47的第二个配体SIRPα,这个配体与免疫信号的传导有关。2009年,Weissman教授再接再厉,将这一发现公开发表于《细胞》,详细阐述了分布在细胞表面的CD47的作用。
CD47几乎广泛表达于所有的正常细胞表面。简单来说,CD47通过与巨噬细胞表面的SIRPα结合,释放一种阻断巨噬细胞吞噬的信号,又称为“别吃我”信号,从而保护健康细胞不被巨噬细胞“吃掉”。不幸的是,癌细胞也学会了这招,在表面表达高水平的CD47,使巨噬细胞把它们当作“正常细胞”,从而躲避被“吃掉”的命运。
目前已知的CD47的天然配体有三种:整合素(integrin)、血小板反应蛋白-1(Thrombospondin-1,TSP-1)和信号调节蛋白α(Signal-regulatory proteinα,Sirpα)。CD47与其配体主要参与细胞黏附、细胞迁移、吞噬功能,以及维持机体免疫稳态。其中,Sirpα的表达局限于巨噬细胞、树突状细胞以及神经细胞表面,是目前主流的开发方向。
针对CD47-SIRPα信号通路的疗法有多种作用机制,主要包括:阻断CD47与SIRPα的结合,切断“别吃我”信号,促进巨噬细胞吞噬肿瘤细胞;CD47抗体可通过促进DC细胞对肿瘤细胞的吞噬作用,随后将抗原呈递给T细胞,刺激抗肿瘤适应性应答;CD47抗体通过NK细胞介导的ADCC和CDC作用杀伤肿瘤细胞;CD47抗体可激活肿瘤细胞凋亡途径,直接诱导肿瘤细胞凋亡。
CD47-SIRPα信号通路具有巨大的治疗潜力,在癌症免疫治疗中,CD47已成为继PD-1/PD-L1之后另一个高度竞争的靶点。目前,靶向该通路的在研药物主要分三类,包括CD47抗体、SIRPα融合蛋白以及SIRPα抗体。
CD47的研发进程并非一帆风顺。
2020年3月,吉利德以49亿美元现金收购肿瘤免疫疗法公司Forty Seven,获得了一款First-in-class的靶向CD47单克隆抗体Magrolimab,奠定了该靶点领航者的地位。
2020年9月,艾伯维斥资19.2亿美元获得了天境生物CD47单抗来佐利单抗的开发和商业化权益。天境生物曾将lemzoparlimab定位为“继magrolimab之后的全球领跑者”。
2022年年初,吉利德CD47单抗magrolimab+阿扎胞苷联合治疗的5项临床研究被FDA部分叫停。原因是研究者报告的疑似意外严重不良反应(SUSAR)在治疗组之间明显不平衡。这一消息也导致布局这一赛道的多家药企股价大跌。
2022年4月11日,吉利德宣布,FDA在回顾了每个试验的综合安全性数据后,解除了该公司在研部分临床暂停。这一消息似乎给研发人员带来了希望。
2022年7月20日,艾伯维终止了与天境生物合作的CD47抗体来佐利单抗(lemzoparlimab)在成人多发性骨髓瘤(MM)上的一项早期研究,引发了业内的轰动。
天境生物今年早些时候披露,“作为免疫肿瘤学中最有前途的一类药物,CD47抗体的开发主要受到其与红细胞(rbc)结合的阻碍。各种CD47抗体在临床阶段被发现易发生严重的贫血和其他血液副作用。因此,许多CD47抗体项目要么在早期临床试验中被终止,要么在临床试验中面临药物安全性挑战。”
CD47靶向药物开发关注的重点是安全有效。除了红细胞毒性、血小板毒性外,还容易引发T细胞毒性,因为T细胞也表达CD47分子,如果抗体与T细胞CD47的某个表位结合,就可能诱导T细胞凋亡。还有血压毒性,有报道称CD47抗体药物使用后会引起低血压。
内卷的CD47赛道,全球目前有超过30家公司正在开发针对CD47靶点的药物,主要涉及单抗、双抗、融合蛋白和小分子。据智慧芽数据库显示,约有45款针对CD47靶点的药物已进入临床研究阶段,暂无该靶点药物上市,最高开发阶段为临床III期。还有3款药物处于临床申请状态,以及超40款药物仍处于临床前阶段。
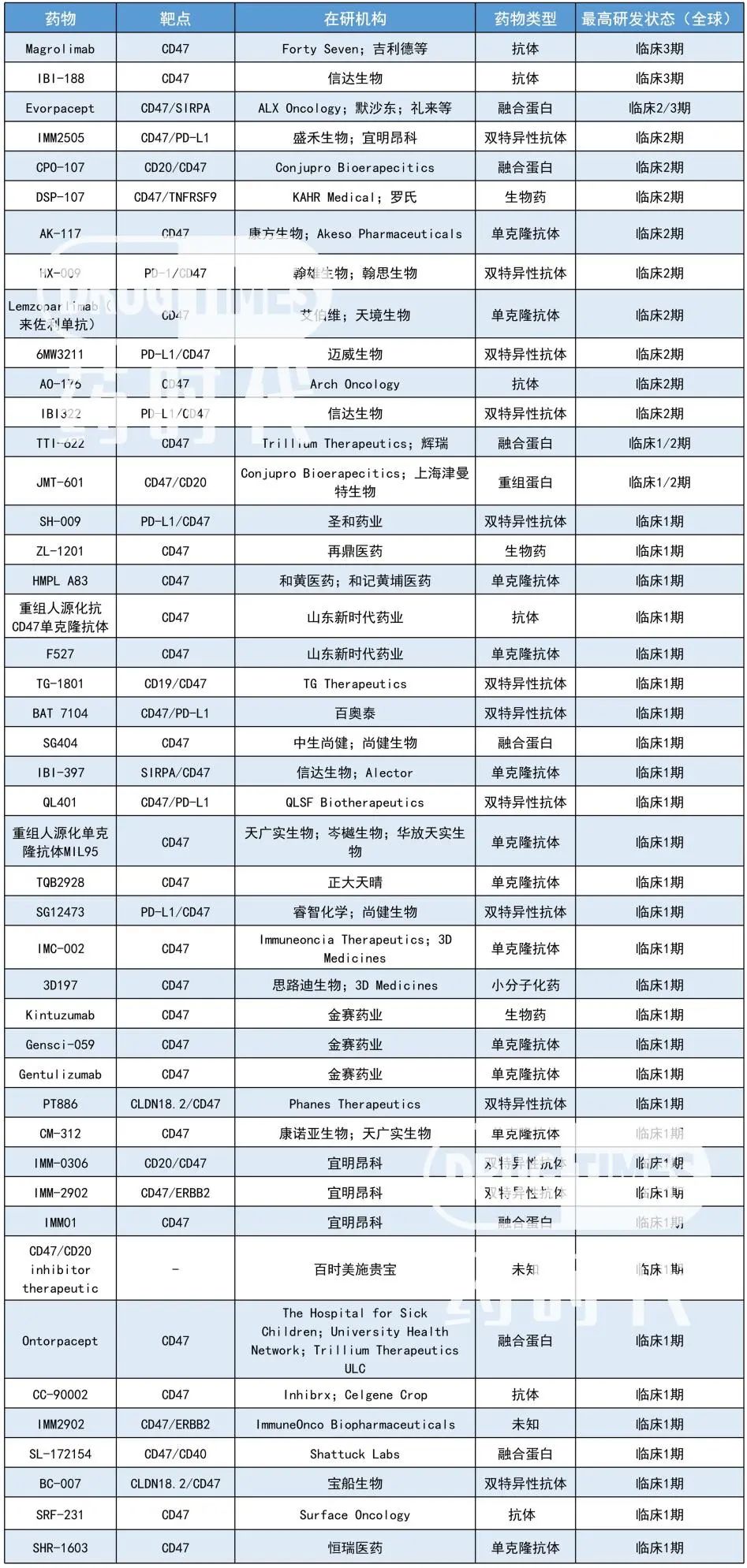
图为全球进入临床阶段的CD47药物,图表为作者自制,数据来自智慧芽数据库
目前,已经进入临床III期的有3款药物,吉利德的Magrolimab(抗体)、信达生物的IBI-188(抗体)、默沙东等的Evorpacept(融合蛋白)。有近11款药物进入了临床II期,其中近7款药物为国内药企。约31款药物进入了临床I期,其中有21款药物为国内药企。
可见,国内药企占据全球同靶点药物研发的半壁江山。包括天境生物、信达生物、再鼎医药、宜明昂科、翰思生物、金赛药业、天广实、康方生物、恒瑞医药等国内药企,都在这一领域有所布局,并取得了一些较好的临床试验结果。
随着龙头公司Forty Seven被Gilead以49亿美金的价格收购,CD47受到的关注逐渐增多。由一些国外头部药企领航,以及众多国内药企跟风。除了吉利德的magrolimab、艾伯维与天境生物合作的来佐利单抗,2021年8月,辉瑞以约22.6 亿美元收购Trillium,获得了阻断CD47-SIRPα信号通路的在研药物TTI-621 和TTI-622。在国外,“三巨头”即吉利德、艾伯维、辉瑞通过收购或达成授权合作的方式,跻身CD47赛道。
CD47是被十分看好的靶点,已经发展到了第三代产品。magrolimab是第一代产品,没有解决红细胞毒性问题;第二代产品采用预激给药策略降低红细胞毒性,但效果仍不理想;来佐利单抗代表第三代产品,通过人源天然噬菌体技术筛选出可以结合在稀有表位上的CD47抗体,降低与红细胞的结合,解决副作用的问题。
在CD47赛道上,天境生物算是国内药企的领军者,再鼎医药算是后起之秀。天境生物的第三代产品来佐利单抗一直被市场看好,而这次联合用药的终止,似乎又堵住了CD47一条开发出路。这两家药企的退出,可能会使后面跟风的国内药企有些不知所措。
从现有的研发情况看,靶点同质化严重,产品缺少差异化。这些问题会导致后期产品商业化遇阻,即便产品最终成功上市,可能也很难占据较大的市场份额。
近年来,CD47抗体在血液肿瘤中应用广泛,研究主要集中于急性髓细胞白血病(AML)及骨髓增生异常综合征(MDS)、非霍奇金淋巴瘤(NHL)及多发性骨髓瘤(MM)等。其中,缺乏有效治疗药物的AML及MDS是热点研究领域,研发的困难就在于其引发的各种毒副作用。
目前,尚未有药品上市的CD47市场,一直以来都是不少药企梦想中的蓝海。或许正因为悬而未决,所以才充满遐想。值得一提的是,大多数在研的CD47药物,由于需要降低红细胞毒性,导致单药效果不理想,因此,目前联合用药策略被看好,但仍处于探索阶段。
吉利德的magrolimab虽然已经走在了最前面,但落在后面的也并非没有机会。就像ADC药物的研发,最先推向市场的一代产品后来又退市了,二代产品仍有局限性,直到三代产品推出后才达到理想的效果,甚至改变了传统的治疗格局。
其实,许多新机制药物即便抢先上市,但第一代产品或多或少都有问题,后起之秀也可以弯道超车。CD47这一赛道的巨大红利,到底花落谁家,是否后来者能居上,还是先发制人拔得头筹,药时代将持续关注!
1、https://endpts.com/anyone-still-looking-for-a-cd47-zai-lab-shelves-phi-program-after-reviewing-competitive-landscape/
2、https://endpts.com/abbvie-calls-off-phi-trial-for-i-mabs-cd47-days-after-zai-lab-shelves-its-own-program/
3、《研究报告 | 靶向CD47药物研发进展》